Современные молекулярные методы позволяют проводить ДНК диагностику племенных животных и выявлять носителей скрытых генетических дефектов, исключая тем самым их из селекционного процесса. В ходе исследований был разработан метод для проведения ПЦР-ПДРФ для идентификации полиморфизма гена SDE2.
крупный рогатый скот, голштинская порода, генетическая аномалия, гаплотип НН6
Введение. Наличие в популяции голштинского скота гаплотипов фертильности, приводящих к эмбриональной, постэмбриональной и постнатальной смертности (гибели) телят, влечет за собой значительные экономические потери и приводит к увеличению в поголовье скота генетических мутаций. Современные молекулярные методы позволяют проводить ДНК диагностику племенных животных и выявлять животных носителей скрытых генетических дефектов, исключая тем самым их из селекционного процесса.
В 2018 году методом идентификации регионов с потерей гомозиготности открыта новая генетическая аномалия крупного рогатого скота голштинской породы в гене SDE2 (OMIA 002149-9913) [1]. В гетерозиготном состоянии она приводит к носительству гаплотипа НН6, в гомозиготном вызывает замедление роста эмбриона и самопроизвольный аборт до 56 дня стельности. Родоначальником этой аномалии считают голштинского производителя MOUNTAIN USAM000002070579 [2].
Материалы и методы исследований. В РУП «Научно-практический центр Национальной академии наук Беларуси по животноводству» были разработаны оптимальные условия проведения ПЦР-ПДРФ для идентификации полиморфизма гена SDE2. Разработанный метод включает следующие основные этапы: получение препаратов ДНК из биообразцов перхлоратным методом; проведение ПЦР; электрофоретическое фракционирование полученных фрагментов ДНК; интерпретация результатов анализа: определение генотипов животных. В качестве биопроб использовали образцы ушной ткани и спермы животных голштинской популяции молочного скота отечественной селекции племенных хозяйств республики в количестве 85 голов.
Результаты исследований. В ходе исследований для изучения полиморфизмов гена SDE2, ассоциированного с фертильностью коров голштинской популяции, был проведен подбор и синтез специфичных праймеров для ПЦР-ПДРФ анализа. В состав реакционной смеси для ПЦР входили: 10х буфер AM с МgCl2; смесь dNTP 2 мМ; 5 ед. акт./мкл Таq-полимеразы; по 25 пМ каждого праймера; Н2О, к которой добавлялось по 100 нг геномной ДНК. Для амплификации фрагмента гена SDE2 проводили ПЦР в реакционной смеси объемом 25 мкл. ПЦР-программа: «горячий старт» – 94ºC – 3 мин; 27 циклов: денатурация - 94ºC – 30 сек, отжиг- 61ºC – 30 сек, синтез – 72ºC – 30 сек; достройка – 72ºC – 3 мин. Длина амплифицированного фрагмента-524 п.о.
Для идентификации аллельных вариантов гена SDE2 использовалась рестриктаза BccI. Реакцию проводили при температуре 37ºС в течении 5-8 часов.
Детекцию результатов амплификации фрагментов гена SDE2 осуществляли электрофоретическим методом в агарозном геле с последующей визуализацией на трансиллюминаторе при помощи компьютерной видеосистемы. Для оценки результатов проведения ПЦР-ПДРФ использовали 2-3% гель. После проведения рестрикции амплифицированного участка гена SDE2 идентифицируются следующие генотипы: НН6F/F фрагменты 278 п.о. и 246 п.о.; НН6F/С фрагменты 524 п.о.,278 п.о. и 246 п.о.; НН6С/С фрагмент 524 п.о (рис. 1).
1 2 3 4 5 6
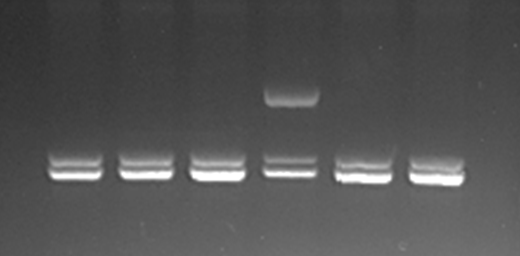
Дорожки 1-3, 5 и 6 – пробы ДНК животных с генотипом HH6 F/F;
дорожка 4 – проба ДНК животного с генотипом HH6 F/C
Рисунок 1 – Электрофореграмма фрагментов рестрикции участка гена SDE2
Заключение. Среди протестированных животных частота мутантного гаплотипа НН6 составила 2,4%. Частота встречаемости аллеля С составила 0,512, а аллеля F – 0,488.
1. Kamiński, S. Missense mutation in SDE2 gene – new lethal defect transmitted into Polish Holstein-Friesian cattle / S. Kamiński // Polish Journal of Veterinary Sciences. – 2019. – Vol. 22, No. 3. – Р. 627–630. – DOI:https://doi.org/10.24425/pjvs.2019.129974.
2. An initiator codon mutation in SDE2 causes recessive embryonic lethality in Holstein cattle / S. Fritz [et al.] // J. Dairy Sci. – 2018. – Vol. 101. – Р. 6220-6231. – DOI:https://doi.org/10.3168/jds.2017–14119.





